Yeast Counting【基本的なやり方】

こんにちは!やざわです。
先日のビアカップはみなさんどうでしたでしょうか。
次のMBCTが楽しみですか、そうですか。僕もめっちゃ楽しみ!!是非、乾杯しましょう🎈
さて、前回はCountingの意義や測定する2つの指標について簡単にまとめました。
今回はいよいよそれを計ってみましょう、実践してみましょうの枠です。日本でもCountingしている醸造所は増えてきているように感じますが、計ってないところも未だに多いと思います。
今回の記事がきっかけで【なんか難しそうだから止めておこう】の壁が少しでも低くなれば幸いです。
Countingすること自体は酒税法にひっかかりませんから、できる方は遊び半分でやってみては🎈
では、早速!
参考文献は前回同様にYeast by Chris Whiteです。
前回の記事は↓↓
Yeast Counting【2つの指標】
ビールの香り【Autolysed/自己融解臭】
最低限用意するもの
酵母の数を数えるためと、2つの指標: Viability(VB)、Vitality(VT)を測定するために必要な道具をまとめます。
②細胞計算盤/Hemocytometer
③カバースリップ(一般的なものよりも厚め)
④Fine-tip glass pipettes
⑤Handheld counter
⑥Transfer pipettes
⑦Kimwipes
⑧Methylene blue solution
①顕微鏡:酵母の大きさは5~10μmくらいですので、400倍で拡大すると2mm~4mmくらいになります。
②Hemocytometer:特定の面積に存在する存在する酵母の数を数えるために必要。
③カバースリップ:文系の僕には分からないが、一般的より厚いとクリス(Yeastの著者)が言うのだから、厚めなんだろう。スライドガラス?って呼んでた記憶があるぞ。
④Fine-tip glass pipettes:直訳は先端が尖ったガラスのピペット。細かい量の調整ができるので、サンプル液を扱う際に使用する。目盛りがついてるものじゃないと使えない。
⑤Handheld counter:カウンター。カチッ、カチッって数数えるやつ。分からない人は小学校の頃思い出してみて。
⑥Transfer pipettes:④との違いは、先端が特に細くなくても良い点。高いけど、しっかりと分量が計れるものが楽なはず。
⑦Kimwipes:キムワイプ。理系の人なら必ず知ってると噂のペーパー。Hemocytometerやカバースリップの掃除をする際に使用したりする。代用品があればそれでも可。もちろん使い捨て。
⑧Methylene blue solution:Viabilityを計るなら必要。ただ、基本的にはCountingはViabilityを計るので、用意する必要がある。この溶液を軸にして、他の測定方法が枝分かれしていく。
Counting【基本の基】

まずは酵母の数を数えるということの準備や手順について紹介します。
ゆくゆくは、Viabilityも同様に数えるようになるのですが。
1.サンプル溶液(酵母数を測定したい溶液)の準備
2.数える/Count
というたった2つの工程です。
サンプル溶液の準備
酵母をカウントするときは、基本的にre-pitch(再利用)のときです。
その酵母はどこから取るのかいうと、もちろんその酵母が使われたビールからということになります。サンプル液の元は3つのルートに分かれます。
壱:Slurry
弐:Fermenting Beer
三:Beer
この3つ。
簡単に説明します。
Slurry:発酵タンクの底に溜まっている固体と液体の中間層。澱引きしたときにドロッと出てくる白~黄色っぽいものがそう(濃色ビールのときは濃色になる)。同体積に占める酵母数が3つの中でもっとも多い。
ドライホップしたビールには、slurryにホップ滓が大量に混ざっている可能性があって、ホップの抗菌作用も相まって再利用に向いてないかも。ドライホップはBBT(Bright Beer Tank)で、と主張される所以の一つ。再利用しないなら、もちろんいつホップを入れてもいい。
Fermenting Beer:その名の通り、発酵中のビール。発酵中にサンプルコックから出てくるビールにはまだ酵母が含まれていてしっかり濁っているはず。酵母数はslurryには劣る。
Beer:発酵が終了して酵母も落ちているビール。濾過していない以上、もちろん0にはならない。ただしラガーリングして1ヶ月置いてたりすると、サンプル液には適してないかも(個人的な予想)。
次は、これらからサンプル液を作るために、純水で薄めてあげる必要があります。
どうしてかというと、酵母数が多すぎたり、少なすぎたりすると正確なCountingにならないからです。サンプル液の理想的な酵母数は50個/1mm^2。
Slurry: 1000倍希釈
Fermenting Beer: 10~100倍希釈
Beer: 希釈なし
推奨されている希釈率です。やってみて、濃かったら薄めればいいので、はじめは濃いめに希釈して慣れたらいいのかもしれません。とりあえず、これでサンプル液の用意はできました。
数える/Count
次はいよいよイーストの数を数えていきます。
正確な酵母を数えるために理想的なサンプル液を用意しました。その次のステップです。
下準備
- Hemocytometerを水洗いして綺麗にしておく。必要ならキムワイプなどで優しく拭く。
- 可能ならばサンプル液から二酸化炭素を抜く。コンタミしない方が大事なのを忘れないこと。
- サンプル液をピペットで採取。
- Hemocytometerとカバースリップを密着させ、隙間にサンプル液を溢れない様に入れる。
- Hemocytometerに気泡、液漏れ、乾いた部分がないことを確認したら、いよいよカウンティング
ただ、これは大学で医学系にいた方や、醸造学科で勉強した方の意見を聞く方がより正確なやり方に近づきそうです。
別のサイトを参考にしてみます。
ガラス製の血球計算盤とカバースリップを使用する場合は、使用前に共にエタノールで洗浄し、風乾させておく。カバースリップを軽く水で湿らせ、血球計算盤に密着させる。適切に密着していれば、カバースリップの下にニュートン・リング(虹のような環)を見ることができる。
abcam より
血球計算盤を用いた細胞数のカウント法
血球計数板(Hemocytometer; ヘモサイトメーター)を用いて培養細胞中の生存細胞数をカウントするプロトコールをご紹介します。
困ったときはここも覗いてみてください。
色々ともっと突っ込まないといけない手順がありそうです。
コンタミしないように脱気するにはどうするべきでしょうか。純粋な二酸化炭素で満ちている容器内を真空状態にしてしまえばいいのですが、一歩間違えばイーストへの負担がとんでもないことになりそうです。
容器内を二酸化炭素で置換し、エアロックを付けた状態で振ってみるのはどうでしょうか。逆流する空気を滅菌するためフィルターを別にかけてもいいかもですね。
話が進まないので、先に行きます。
これでようやくカウンティングする手前に来ました。では、顕微鏡を覗くところまでいきましょう。
counting
- 顕微鏡を400倍でピントが合うように調整
- イーストがばらついているかどうかの確認
- ばらついていない→ short cell count
- ばらついてる→ long cell count,破棄して採取し直し
調整の仕方は如何様なので、各理科の授業や上にはったウェブからどうぞ。 Hemocytometerの画像を分かりやすいように張っておきます。
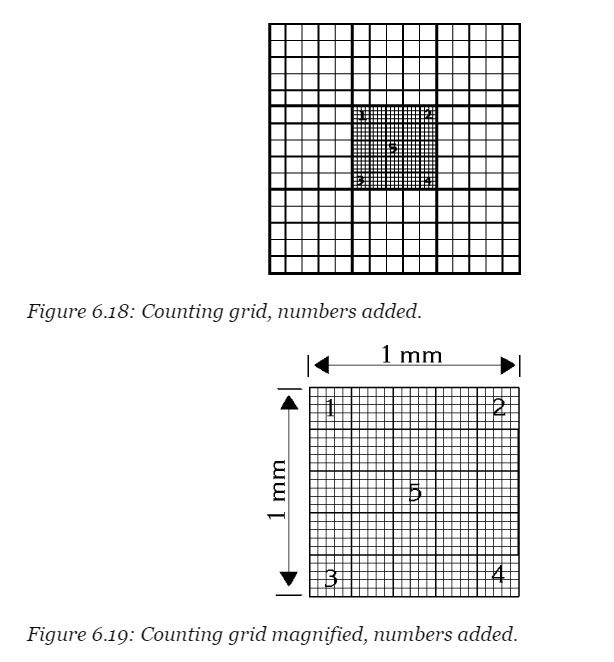
counting rule
単に決められた枠内のイーストの数を数えるように思えますが、少しだけ決めておかないといけないルールがあります。
①一番外側4辺のうち、2辺をチョイスする 例:上辺と右辺
②選択した辺にまたがって存在するイーストを0.5分としてカウント
③ラインにまたがっていない細胞を数えて、②との合計を出す
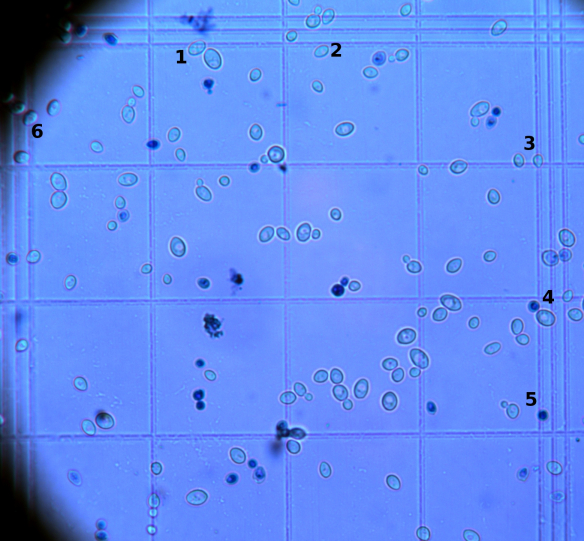
例えば、上の図6.19の5番の部屋にあるイーストをカウンティングするときを考えます。その下に実際にカウンティングする際の参考画像です。
この画像は染色しているときの画像なので、青い細胞がありますが、今回はこれもすべて1つの細胞としてカウントします。左右両辺と、上辺の格子線が3本になっているのが確認できます。これが、1mm*1mmの部屋を25に分けている部屋の区切りを示しています。なので、この3本線に囲まれている部屋を数えます。そして、この3本線の一番内側の線にまたがっているかどうかを判断します。
まず①のルールに則ります。今回は上辺と右辺をチョイスします。
画像に1~6までの番号が振ってあるのが確認できます。1は、まさにラインにかかってますね。0.5個です。2もほとんどかかってないですが、少しでもかかっていたら「またがっている」細胞ですので0.5個です。3はいいとして、4みたいに、逆にほとんどかかってないやつもカウントします。4の上にも細胞がありますが、これは3本線の一番内側にかかってないので、カウントしません。5番も色こそおかしいですが、カウントします。
6番はどうでしょうか。これは左辺なので、内側にかかっていてもカウントしません。
こんな感じで全てのまたがった細胞を数えたら、②までは来れました。
お次は③ですが、これはもう愚直に数えてください。笑
どうやって数えるのがbetterなのかは、色々ありそうですけど、一番小さい部屋ごとに数えるのがいいのかな。そのときもルール決めないと、またがった細胞を2重に数えることになりますから、気をつけてください。
今回の図では70個くらいいそうですね。
これを1mm^2の部屋25個数えるまでくり返すのが、long cell countで、5個でいいのが short cell countってだけです。
short cell count
イーストがばらついてる場合、カウントする場所(Hemocytometerの格子)が減ります。上の図を参考にすると、1mm^2の部屋が9つあるのがわかります。その部屋一つは更に細かく25個に分かれていて、更に細かく25個の部屋にわかれています。カウントすべきところは図6.19で番号が振ってある5つの部屋(一番小さい部屋が25個*5)のみでOKです。
イーストの総数(1mm^2):short cell count amount(個)*5
long cell count
イーストがばらついていない場合、正確なイーストの数を図るためにカウントする場所を増やします。short cell countとは異なり、1mm^2の空間すべてのイーストをカウントします。それが総数です。
さて、これでとりあえず、イーストを数えるという行為はできました。次は得られた数字から、サンプル液1Lにどれくらいイーストがいるか求めてみましょう。
サンプル液のイースト数
駆け足でいきますので、紙とペンあった方がいいかも。。。
short cell count を採用した場合、それぞれの部屋に 60, 66, 74, 45, 55 個のイーストがいたとします。そしたら、総数は、300個ですね。
1mm^2の部屋には100nLのサンプル液が入ります。
1500個/100nL=1.5*10^3*10^4/1mL=1.5*10^7個/1mL
これが100倍に希釈したサンプル溶液ならば、元々の酵母液にはイースト数は
こんな感じで出ます!
例えば、500LのOG1.048(12°P)のwortをpitch rate0.75で発酵した場合はこの酵母液を何L入れたらいいでしょうか?
酵母液のイースト数=1.5*10^9/mL
必要なイースト液量=4.5*10^12/1.5*10^9=3.0*10^3mL
つまり、3L必要!と、出るわけですね。
まとめ
最後の駆け足たるやいなや、、
これも全て僕が実際にカウンティングしたことの経験が浅すぎるからなんですが、この記事は随時更新しようと思います!もし、アドバイスなどがありましたら、教えていただけると嬉しいです🎈
ただ、あーこんな感じか!と。
簡単だな、と垣根が少しでも低くなれば幸いです。実際にはいろいろなテクニックがあって、慣れるまでは時間がかかるでしょうが、世界では一般的な技術なはずです。
採用するかしないかは醸造所の判断ですが、練習しておくことに損はないと思います!
次回はいよいよメチレンブルーなどの染色について紹介していきます。
実際にはイーストの数のみを数えるということは少なく、一緒にできてしまうので染色もするというのが一般的なのかなーと思います。ゆっくり待ってくれたらと!笑
.jpg)














Reply